Como ya debéis saber, este año el Premio Nobel de Química ha recaído en tres investigadores cuyos trabajos permitieron describir y aplicar la proteína verde Fluorescente.
Oligodendrocito. Wikimedia commons
Científicos galardonados
Neuronas piramidales. Imagen del artículo de PLoS, de Wei-Chung Allen Lee y colaboradores. Vía Wikimedia commons
¿Tan importante es una proteína de medusa que la hace brillar en tonos verdes? Pues sí. La aplicación de esta proteína en los campos de la biomedicina ha permitido realizar estudios que antes, o bien eran caros o difíciles de realizar, o bien no podían ni soñarse. A parte de su innegable uso científico (15163 artículos a día de hoy en PubMed contienen "GFP"), el uso de estas proteínas está generando toda una serie de imágenes de una belleza difícil de creer. Por el cambio en los métodos de estudio biomédicos que ha supuesto, se ha comparado su aplicación con la creación del microscopio; por la fantástica calidad artística de algunas de las imágenes que se han obtenido, yo lo compararía con el Hubble.
Método de uso
La proteína GFP viene codificada por el gen de la GFP. Los genes son secuencias de DNA. Las técnicas de ingeniería genética permiten trabajar cada vez más fácilmente con estas secuencias de nucleótidos.
No todo el DNA está formado por genes; existen secuencias de DNA que no codifican para ninguna proteína, es decir, no se "transcriben" a RNA, ni, por tanto, se "traducen" a proteína. El DNA no codificante que se encuentra colindante al inicio de un gen suele controlar la expresión de éste. Como ya dijimos en Back to the future, estas secuencias son las regiones reguladoras, los interruptores que "dicen" cuándo, cómo, dónde y en qué cantidad se va a producir la proteína codificada por ese gen en concreto.
Raíz de Arabidopsis. Wikimedia commons
Si ponemos la GFP delante de una de estas secuencias, la proteína verde se expresará en los mismos lugares, momentos y en las mismas cantidades en los que se expresaría el gen controlado por esa región controladora. Es decir, si queremos conocer dónde se expresa una proteína, podemos generar un animal transgénico en el que hayamos introducido la GFP delante de la región reguladora del gen problema. Las células que brillen verdes serán las que lo expresen.
Otro uso. La GFP (y sus derivados), se pueden unir a anticuerpos. Recordad que los anticuerpos son proteínas que reconocen específicamente determinados antígenos. Actualmente existen varios miles de anticuerpos comerciales, cada uno de ellos capaz de reconocer una porción de proteína en concreto. Si ponemos anticuerpos con GFPs éstos se unirán a las proteínas específicas y "brillarán" señalizando su situación. Así, podemos obtener "fotos" de células con regiones intracelulares teñidas de diferentes colores (uno para cada proteína reconocida por cada anticuerpo marcado).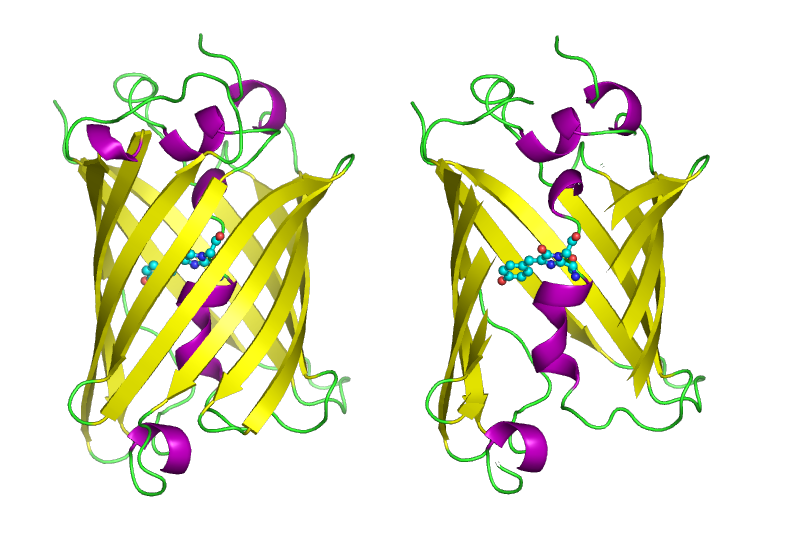
Estructura 3D de la GFP. A la derecha, GFP "cortada" para dejar ver el fluróforo. Wikimedia commons
¿Es posible separar poblaciones de células con estas proteínas?
Si combinamos este "marcaje" en diferentes colores, con un aparato denominado "Citómetro de flujo", podemos, incluso, separar poblaciones de células. Intentaré explicarlo. En el citómetro de flujo se coloca la muestra, formada por una suspensión de millones de células que queremos separar. Imaginad que por un lado queremos células que expresen sólo una proteína que, mediante anticuerpos, hemos marcado en verde; mientras que en la otra población queremos células que sólo expresen una proteína que hemos marcado en rojo; las células que no tienen esas proteínas, o las que tienen las dos, no nos interesan. ¿Y para qué? Pues, por ejemplo, para conseguir poblaciones aisladas de mastocitos (unos glóbulos blanco concretos) y de macrófagos (otros glóbulos blancos).
Tubo de muestras en el citómetro de flujo.Wikimedia commons
Pues bien, el citómetro tiene un capilar por donde va pasando la muestra. Este capilar es de un grosor tal que sólo puede pasar una célula por él. Sobre el capilar inciden una serie de láseres que van analizando cada una de las células. Dependiendo del color en que brillan las células se activa una palanca que va dirigiendo la gota que contiene esa célula hacia un tubo u otro. ¡Y todo esto a una velocidad pasmosa! Verlo en acción es toda una experiencia.
Usos sofisticados de la GFP
Y así, hasta llegar a los usos más sofisticados de estas proteínas. Existe una maravillosa página sobre la proteína GFP de Marc Zimmer, en la que podéis encontrar muchísima información sobre esta proteína. En esta página existe un apartado (Cool uses) en el que se muestra algunos de los usos más espectaculares: 
Rana con los ojos "brillantes".Wikimedia commons
A estos usos, habría que añadir otros más "creativos", como los limoneros-farolas que comentamos en Mi limón, mi limonero, brillante me gusta más.
No es GFP todo lo que reluce
Por último quiero romper una lanza a favor de otras herramientas "fluorescentes" de los biólogos.
Luciferasa, un gen de luciérnagas, entre otros. ¡Ay! ¡Qué recuerdos! ¡Cuántos experimentos introduciendo la luciferasa clonada delante del "interruptor" de la MKP-1 (una proteína a la que acabé cogiéndole cariño, no os preocupéis) en células que luego trataba para ver los cambios en su expresión! Siento la frase enrevesada, pero uno también tiene sus recuerdos... Este es otro uso de las proteínas fluorescentes: si quieres saber cómo altera la expresión de un gen un fármaco en concreto (si, si, muchos fármacos producen cambios en la expresión de nuestros genes), puedes poner una proteína fluorescente delante del "interruptor" de este gen y añadir diferentes concentraciones del fármaco para luego medir la fluorescencia. A más fluorescencia, más se expresaría el gen. 
Representación 3D de la luciferasa. Wikimedia commons
Una aclaración, la luciferasa no es fluorescente. De hecho, la luciferasa es una enzima que hace que un reactivo, la luciferina, brille.
Fluoróforos
La fluoresceína (verde), la rodamina (roja), la cianina (azul), y otros, son compuestos con brillo propio también usados en marcaje proteico.
12/10/08
De Nobels, GFPs, luciferasas y fluorescencia
Publicado por
Salva
en
22:25
![]()
Etiquetas: Actualidad, Biología celular, Biología molecular, Genética
Suscribirse a:
Enviar comentarios (Atom)






No hay comentarios:
Publicar un comentario